GFS-3000——光合作用研究的最顶级设备
德国WALZ公司是全球最好的光合作用仪制造商之一,从1972年开始制造气体交换测量系统,先后生产过CMS-400、CQP-130、HCM-1000等光合仪,并在国际上得到广泛应用。在总结30余年设计制造经验的基础上,结合最新的技术进展,WALZ公司于2004年隆重推出了一款功能更加强大、设计更加人性化的便携式光合-荧光测量系统——GFS-3000。
GFS-3000解决了近10年来光合领域在实际测量过程中(特别是野外测量时)遇到的许多技术问题,设计非常人性化。您在使用中会感觉到,在操作的任何一个过程中,GFS-3000都是站在用户的角度切身为您考虑的。
GFS-3000的一个特点是允许多种模式同步测量气体交换和叶绿素荧光,解决单一技术无法解释的机理性问题。GFS-3000既可以在人工光下同步测量气体交换和叶绿素荧光,又可以在完全不遮荫的自然光下同步测量气体交换和叶绿素荧光(独家技术!),甚至还可以同步测量气体交换和叶绿素荧光成像(独家技术)!!!

1. 特点
1.1 H2O、CO2、温度与光照的精确控制与测量
1)高精度4通道绝对开路式非扩散红外气体分析器(CO2和H2O各2个通道)
2)出色的温度控制范围:从+50℃到低于环境温度10℃(同类产品中控温范围最大)
3)出色的温度控制模式:控制叶室跟踪环境温度;设置恒定叶室温度(叶片温度可变);设置恒定叶片温度(叶室温度可变)
4)干、湿双重H2O控制系统(全球唯一),完全满足从西北干旱区到华南潮湿区的光合作用研究需要(0-75 000 ppm)
5)整合式CO2控制系统
6)CO2小钢瓶气密性极佳,一次未用完可完全密闭待后续使用(同类产品的CO2小钢瓶打开后1天内气体就会漏完),大大节省耗材费用
7)出色的红蓝LED光源控制系统
8)外置滤器,方便更换(用户不会再因为将仪器寄回厂家更换滤器而耽误实验了)
9)外置流量仪(同类产品都放在主机内部),方便检查夹住叶片后叶室是否密封(如果叶室不密封,则所有测量的光合参数都是错误的!)

1.2 出色的叶室设计
1)多种叶室可选,样品面积即使低至0.5 cm2也可得到满意的结果
2)更换叶室时只需更换配件,大大节省了野外更换叶室所需时间(同类产品多为整体更换,花费大量时间)
3)支持用户自定义叶室(最大可达1 L)
4)3个PAR探头,分别跟踪记录环境PAR、叶室内叶片正面PAR和叶片背面PAR(叶室内叶片背面PAR探头是第一次出现,大大降低了只根据叶片正面PAR计算光合产量引起的误差)
5)叶室双路通风系统,保证叶室上、下部气体迅速混匀

1.3 三种模式同步测量气体交换和叶绿素荧光
1)可与荧光附件连用,可与MINI-PAM、IMAGING-PAM连用
2)在人工光(仪器提供的可控光)下同步测量气体交换和叶绿素荧光
3)在自然光下(完全不遮荫)同步测量气体交换和叶绿素荧光(独家技术)4)同步测量气体交换和全叶片荧光成像(独家技术)
1.4 方便的操作与数据处理
1)大屏幕触摸式显示器,带背景光,可在所有环境下清楚显示
2)简单易学的编程功能,可在电脑上模拟操作
3)USB 2.0电脑接口,可与所有笔记本电脑连接(抛弃了RS 232接口,因为市面上95%以上的笔记本电脑不带RS 232接口)
2. 测量参数
2.1 气体交换参数:
参比室和样品室的CO2绝对值(CO2abs,CO2sam),参比室和样品室的H2O绝对值(H2Oabs,H2Osam),流速(gas flow),环境气压(Pamb),叶室温度(Tcuv),叶片温度(Tleaf),环境温度(Tamb),环境PAR(PARamb),叶室内叶片正面PAR(PARtop),叶室内叶片背面PAR(PARbot),叶室相对湿度(rh),蒸腾速率(E),水气压饱和亏(VPD),叶片气孔导度(GH2O),净光合速率(A),胞间CO2浓度(Ci),环境CO2浓度(Ca)等。
2.2 叶绿素荧光参数:与选择的荧光附件或荧光仪的型号有关,见3.1-3.3节。
3. 同步测量气体交换和荧光的三种模式
3.1 模式一:
与荧光附件3055-FL连用(类型:GFS-3000/FL),在人工光(仪器提供的可控光)下同步测量气体交换和叶绿素荧光。
3.2 模式二:
与荧光附件3050-F连用(类型:GFS-3000/F),或与超便携式调制荧光仪MINI-PAM连用(类型:GFS-3000/M),在自然光下(完全不遮荫)同步测量气体交换和叶绿素荧光。与调制荧光成像系统IMAGING-PAM(MINI-探头)连用(类型:GFS-3000/IM),同步测量气体交换和全叶片荧光成像
IMAGING-PAM可单独使用,测量上述参数的全叶片荧光成像。
还可选配IMAGING-PAM的GFP成像探头。
4. 基本配置比较

测量的荧光参数:Fo, Fm, Fm', F, Fo', Fv/Fm , ΔF/Fm'=Y(II), qP, qL, qN, NPQ, Y(NPQ), Y(NO), rETR等

荧光附件3050-F
 
MINI-PAM利用微光纤可与GFS-3000连用

连接微光纤后,仍可与红蓝光源连用在人工光下同步测量气体交换与叶绿素荧光
测量的荧光参数:
3050-F:Fo, Fm, Fm', F, Fv/Fm , ΔF/Fm'=Y(II), qP, qL, qN, NPQ, Y(NPQ), Y(NO), rETR等
MINI-PAM:Fo, Fm, Fm', F, Fv/Fm , ΔF/Fm', qP, qN, NPQ, rETR等
MINI-PAM可单独使用,单独使用时还可测量PAR、叶温和快速光曲线(RLC)等。
3.3 模式三:
 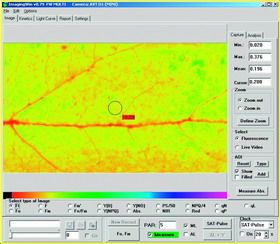
|
GFS-3000与IMAGING-PAM的MINI-探头连用 |
荧光成像 | 测量的荧光参数:Fo, Fm, Fm', F, Fv/Fm , ΔF/Fm'=Y(II), qP, qL, qN, NPQ, Y(NPQ), Y(NO), rETR, PAR Abs(叶片吸光系数)等的荧光成像。
|
配置 |
GFS-3000/P单纯的气体交换测量系统,不能测量荧光 |
GFS-3000/FL可在人工光下同步测量气体交换和荧光 |
GFS-3000/F可在自然光下同步测量气体交换和荧光 |
GFS-3000/M
可在自然光下同步测量气体交换和荧光,两台仪器可分开使用 |
GFS-3000/IM同步测量气体交换和荧光成像,两台仪器可分开使用 |
| 气体交换系统 |
|
|
|
| |
| 主机3000-C(包括CO2注入系统) |
● |
● |
● |
● |
● |
| 锂电池3025-A |
● |
● |
● |
● |
● |
| 锂电池充电器LC-02 |
● |
● |
● |
● |
● |
| 交流电适配器3020-N |
● |
● |
● |
● |
● |
| 叶室 |
|
|
|
| |
| 标准叶室3010-S |
● |
● |
● |
● |
● |
| 叶室配件 |
○ |
○ |
○ |
○ |
○ |
| 柱状叶室 |
○ |
○ |
○ |
○ |
○ |
| 针叶/簇叶叶室 |
○ |
○ |
○ |
○ |
○ |
| 拟南芥植株叶室 |
○ |
○ |
○ |
○ |
○ |
| 红蓝光源 |
|
|
|
| |
| 红蓝LED光源3040-L |
● |
|
● |
● |
● |
| 调制荧光系统 |
|
|
|
| |
| 荧光附件3055-FL |
|
● |
|
| |
| 荧光附件3050-F |
|
|
● |
| |
| 荧光仪MINI-PAM |
|
|
|
● |
|
| 荧光仪IMAGING-PAM |
|
|
|
|
● |
● 包含 ○ 可选
WALZ 隆重推出光合仪O2传感器
 
经过WALZ工程师的不懈努力,泽泉科技为广大用户带来了首创的GFS-3000附件——O2传感器,通过装配在GFS-3000上,可以通过控制条件来监测氧气变化环境下植物的光合荧光同步变化情况。另外该传感器可单独使用。
光呼吸(Photorespiration)是所有进行光合作用的细胞(该处“细胞”包括原核生物和真核生物,但并非所有这些细胞都能运行完整的光呼吸)在光照和高氧低二氧化碳情况下发生的一个生化过程。它是光合作用一个损耗能量的副反应,过程中氧气被消耗,并且会生成二氧化碳。如果光呼吸发生在进行光合作用的生物中,那么光呼吸会抵消约30%的光合作用。因此降低光呼吸被认为是提高光合作用效能的途径之一。
气体交换技术测量光合速率由于自身技术原因无法排除光呼吸的干扰。为了更准确地反映光合速率,可以通过降低氧气浓度,抑制光呼吸来实现。为此,我们提供了氧气传感器,结合控制实验,来监测外界进入仪器气路的氧气情况,以减少光呼吸对光合的影响。
单独使用该传感器时,具有更广泛的应用范围。
部分文献
1. Zarco-Tejada PJ, Berni JAJ, Suárez L, Sepulcre-Cantó G, Morales F, Miller JR: Imaging chlorophyll fluorescence with an airborne narrow-band multispectral camera for vegetation stress detection Remote Sensing of Environment 2009, 113(6):15.
2. Tian Z-Q, Zheng B-H, Liu M-Z, Zhang Z-Y: Phragmites australis and Typha orientalis in removal of pollutant in Taihu Lake, China Journal of Environmental Sciences 2009, 21(4):440-446.
3. Su H, Li Y-G, Lan Z-J, Xu H, Liu W, Wang B-X, Biswis DK, Jiang G-M: Leaf-level plasticity of Salix gordejevii in fixed dunes compared with lowlands in Hunshandake Sandland, North China. Journal of Plant Research 2009:in press.
4. Pascual I, Azcona I, Morales F, Aguirreolea J, Sánchez-Díaz M: Growth, yield and physiology of Verticillium-inoculated pepper plants treated with ATAD and composted sewage sludge Plant and Soil 2009, 319(1-2):291-306.
5. Dai Y-J, Shen Z-G, Liu Y, Wang L-L, Hannaway D, Lu H-F: Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg Environmental and Experimental Botany 2009, 65(2-3):177-182.
6. Stoll M, Schultz HR, Baecker G, Berkelmann-Loehnertz B: Early pathogen detection under different water status and the assessment of spray application in vineyards through the use of thermal imagery Precision Agriculture 2008, 9(6):407-417.
7. Ranf S, Wünnenberg P, Lee J, Becker D, Dunkel M, Hedrich R, Scheel D, Dietrich P: Loss of the vacuolar cation channel, AtTPC1, does not impair Ca2+ signals induced by abiotic and biotic stresses. The Plant Journal 2008, 53(2):287-299.
8. Kocal N, Sonnewald U, Sonnewald S: Cell wall-bound invertase limits sucrose export and is involved in symptom development and inhibition of photosynthesis during compatible interaction between tomato and Xanthomonas campestris pv. vesicatoria. 2008:in press.
9. Horst RJ, Engelsdorf T, Sonnewald U, Voll LM: Infection of maize leaves with Ustilago maydis prevents establishment of C4 photosynthesis. Journal of Plant Physiology 2008, 165(1):19-28.
10. Escher P, Peuke AD, Bannister P, Fink S, Hartung W, Jiang F, Rennenberg H: Transpiration, CO2 assimilation, WUE, and stomatal aperture in leaves of Viscum album (L.): Effect of abscisic acid (ABA) in the xylem sap of its host (Populus x euamericana) Plant Physiology and Biochemistry 2008, 46(1):64-70.
11. Dai Y-J, Shao M-M, Hannaway D, Wang L-L, Liang J-P, Hua L, Lu H-F: Effect of Thrips tabaci on anatomical features, photosynthetic characteristics and chlorophyll fluorescence of Hypericum sampsonii leaves. Crop Science 2008, 28(4):327-332.
12. BOKHORST S, BJERKE JW, BOWLES FW, MELILLO J, CALLAGHAN TV, PHOENIX GK: Impacts of extreme winter warming in the sub-Arctic: growing season responses of dwarf shrub heathland. Global Change Biology 2008, 14(11):2603-2612.
13. Bjerke JW: Ice encapsulation protects rather than disturbs the freezing lichen. Plant Biology 2008, 11(2):227-235.
14. Biswas DK, Xu H, Li YG, Sun JZ, Wang XZ, Han XG, Jiang GM: Genotypic differences in leaf biochemical, physiological and growth responses to ozone in 20 winter wheat cultivars released over the past 60 years. Global Change Biology 2008, 14(1):46-59.
15. 徐飞, 郭卫华, 王玉芳, 王炜, 杜宁, 王仁卿: 济南市校园6个绿化树种光合荧光特征比较初探. 山东大学学报 2007, 42(5):1-9.
16. 徐飞, 郭卫华, 王炜, 徐伟红, 王玉芳, 王仁卿: 黄河三角洲柽柳与芦苇光合特性比较. 山东林业科技 2007(6):29-33.
17. Xu H, Biswas DK, Li W-D, Chen S-B, Zhang L, Jiang G-M, Li Y-G: Photosynthesis and yield responses of ozone-polluted winter wheat to drought Photosynthetica 2007, 45(4):582-588.
18. Xu F, Guo W-H, Wang Y-F, Wang W, Du N, Wang R-Q: Photosynthetic fluorescence characteristics of six greening tree species on university campuses in the city of Jinan. Acta Chimica Sinica 2007, 42(5):86-94.
19. Behnke K, Ehlting B, Teuber M, Bauerfeind M, Louis S, Hansch R, Polle A, Bohlmann J, Schnitzler J-P: Transgenic, non-isoprene emitting poplars don't like it hot. Plant Journal 2007:in press.
20. Barnard RL, Salmon Y, Kodama N, Sorgel K, Holst J, Rennenberg H, Gessler A, Buchmann N: Evaporative enrichment and time lags between 18O of leaf water and organic pools in a pine stand. Plant Cell and Environment 2007, 30:539-550. |